Нейродегенеративные расстройства, такие как болезнь Альцгеймера и болезнь Паркинсона, возникают в результате потери определенных типов нейронов из-за аномального накопления мутантных белков. Хотя было обнаружено, что определенные области мозга особенно уязвимы при каждом из этих расстройств, причины и точные механизмы, лежащие в основе этой дифференциальной уязвимости клеток и областей мозга к токсичным мутантным белкам, не совсем понятны.
В недавнем исследовании, проведенном в лаборатории доктора Худы Зогби, выдающегося профессора Медицинского колледжа Бейлора и директора-основателя Института неврологических исследований Яна и Дэна Дунканов (Duncan NRI) в Техасской детской больнице, этот вопрос рассматривался в контексте спиноцеребеллярной атаксии. тип 1 (SCA 1) и выявил разнообразие молекулярных механизмов и путей, которые способствуют развитию этого нейродегенеративного расстройства.
Открытие, опубликованное в журнале Neuron , намечает путь исследования для лучшего понимания региональной уязвимости при других нейродегенеративных расстройствах.
SCA1 представляет собой прогрессирующее нейродегенеративное заболевание, которым страдают примерно один или два человека из 100 000 во всем мире, и которое в первую очередь характеризуется потерей координации движений и равновесия. Это вызвано наличием мутантного белка ATXN1, имеющего длинные непрерывные участки, называемые полиглутаминовыми (polyQ) повторами.
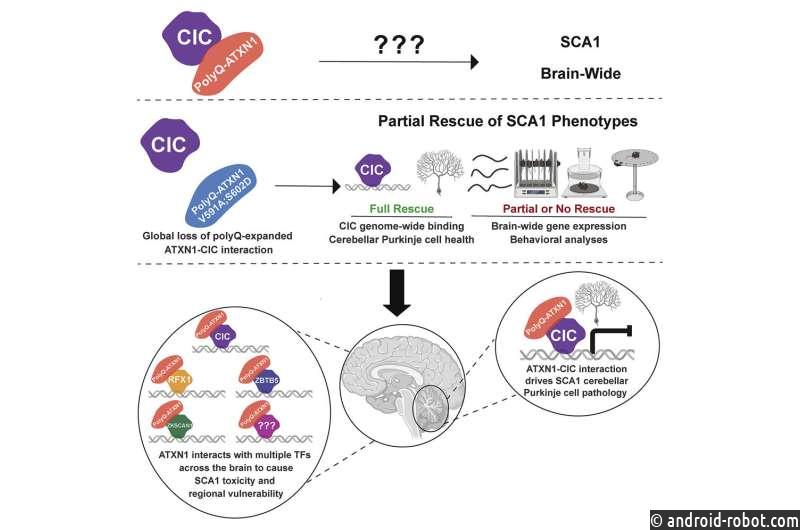
В здоровых нейронах ATXN1 взаимодействует с капикуа (CIC), белком, подавляющим экспрессию нескольких генов. С другой стороны, когда мутантный ATXN1 связывается с CIC, гены-мишени CIC гиперэкспрессируются, что в конечном итоге токсично для нейронов. Предыдущие исследования показали, что все изменения в клетках Пуркинье мозжечка на моделях мышей SCA1 являются результатом повышенной активности комплекса ATXN1-CIC.
Однако белок ATXN1 широко экспрессируется и функционирует в различных областях мозга .
«Ключевой вопрос, который на удивление остался неисследованным, заключается в том, вызывает ли CIC токсичность ATXN1 в других областях мозга или другие молекулярные игроки вызывают токсичность в других пораженных нейронах», — сказал Зогби, который также является исследователем Медицинского института Говарда Хьюза.
Чтобы ответить на этот вопрос, Стефани Коффин, аспирант лаборатории Зогби, создала новую модель мыши SCA1, чтобы имитировать мутацию ATXN1 человека и ее влияние на весь мозг. В этой модели ген ATXN1 имеет расширенный полиглутаминовый участок, но она также мутировала две аминокислоты, которые являются критическими для взаимодействия ATXN1-CIC.
Команда Zoghbi обнаружила, что эти две мутации полностью устраняют взаимодействие ATXN1-CIC во всех областях мозга.
«Нарушение комплекса ATXN1-CIC привело к частичному улучшению неврологических симптомов SCA1, таких как нарушение координации движений , дыхания и короткая продолжительность жизни, и вернуло к норме только подмножество изменений экспрессии генов», — сказал Коффин.
«Вместе эти результаты дали нам ключ к пониманию того, что CIC, вероятно, не единственный взаимодействующий элемент ATXN1, который управляет SCA1, и что дополнительные молекулярные игроки могут способствовать развитию и прогрессированию различных неврологических симптомов, наблюдаемых у пациентов с SCA1 и животных моделях».
Чтобы идентифицировать дополнительные взаимодействующие факторы ATXN1, они провели объективный протеомный скрининг с использованием иммунопреципитации и масс-спектрометрии.
«Учитывая, что транскрипционные изменения являются отличительной чертой SCA1, мы сосредоточились на трех факторах транскрипции, которые экспрессируются в различных областях мозга человека и мыши, называемых ZKSCAN1, ZBTB5 и RFX1», — добавил Коффин, который в настоящее время является менеджером нейробиологической программы в Pelagos. Фарма.
«Мы подтвердили взаимодействие между ATXN1 и этими недавно идентифицированными партнерами и обнаружили, что экспрессия генов, регулируемых RFX1 и ZKSCAN1, была изменена у мышей SCA1 и нейронов человека. Более того, эти два недавно идентифицированных партнера — RFX1 и ZKSCAN1 — вместе с CIC являются предсказано, что они регулируют около 33% генов, экспрессия которых изменена в моделях мышей SCA1, подчеркивая важную роль, которую они играют в патогенезе этого расстройства».
«Мы были весьма удивлены, обнаружив, что для этого нарушения одного гена мутантный белок использует разных партнеров для повышения токсичности в разных клетках мозга», — сказал Зогби. «На самом деле, это исследование подчеркивает важность изучения партнеров других белков, вызывающих заболевание, не только для других полиглутаминовых заболеваний, но и, в целом, для всех нейродегенеративных расстройств. Только благодаря таким систематическим исследованиям мы можем понять механизмы, вызывающие эти заболевания и быть в лучшем положении для изучения терапевтических вмешательств».