Исследователи из Медицинской школы Вашингтонского университета в Сент-Луисе обнаружили новый способ введения лекарств, который потенциально можно использовать для предотвращения деменции при болезни Альцгеймера.
Накопление бета-амилоида в головном мозге является первым шагом в развитии деменции при болезни Альцгеймера. Ученые потратили бесчисленное количество часов и миллионы долларов на поиск способов удаления амилоида до появления когнитивных симптомов, но в основном с разочаровывающими результатами.
В этом исследовании, опубликованном 24 августа в журнале Brain, исследователи нашли способ увеличить выведение продуктов жизнедеятельности из мозга мышей за счет усиления генетической особенности, известной как считывание. Эта же стратегия может быть эффективна и при других нейродегенеративных заболеваниях , характеризующихся накоплением токсичных белков, таких как болезнь Паркинсона, говорят исследователи.
Время от времени мозговой белок аквапорин 4 синтезируется с дополнительным маленьким хвостиком на конце. Сначала Даршан Сапкота, доктор философии, который руководил этим исследованием, будучи исследователем с докторской степенью в Вашингтонском университете, а сейчас является доцентом биологических наук в Техасском университете в Далласе, думал, что этот хвост представляет собой не что иное, как случайный сбой контроль качества в процессе производства белка.
«Мы изучали очень шаткий вопрос фундаментальной науки — «Как образуются белки?» — и заметили одну забавную вещь», — сказал старший автор Джозеф Д. Догерти, доктор философии, профессор генетики и психиатрии Вашингтонского университета. и бывший наставник Сапкоты. «Иногда механизм синтеза белка пропускал знак «стоп» в конце и делал этот дополнительный бит на конце аквапорина 4. Сначала мы думали, что это не имеет значения. Но затем мы посмотрели на последовательность гена, и он сохранялся у разных видов. И у него был действительно поразительный образец в мозгу: он был только в структурах, которые важны для очистки отходов. Вот тогда мы и заволновались».
Ученым уже было известно, что механизм синтеза белка в клетке иногда не останавливается там, где должен. Когда механизм не останавливается — явление, известное как считывание, — он создает расширенные формы белков, которые иногда функционируют иначе, чем обычные формы.
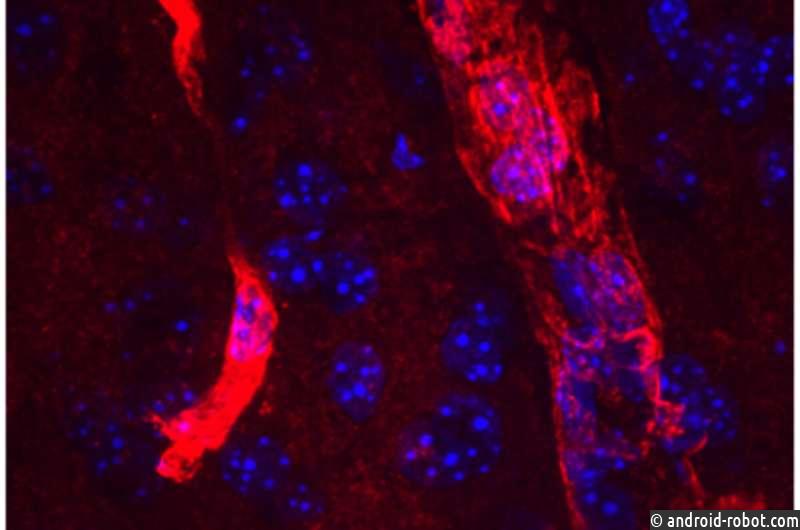
Сапкота и Догерти создали инструменты, чтобы увидеть, ведет ли себя длинная форма аквапорина 4 в мозге иначе, чем обычная форма. Они обнаружили длинную форму — но не короткую — в так называемых концевых ножках астроцитов. Астроциты являются своего рода опорными клетками, которые помогают поддерживать барьер между мозгом и остальным телом. Их кончики обвивают крошечные кровеносные сосуды в мозгу и помогают регулировать кровоток. Астроцитарные концевые ножки — идеальное место, если ваша работа состоит в том, чтобы уберечь мозг от нежелательных белков, вымывая отходы из мозга в кровоток, где их можно унести и утилизировать.
Думая, что увеличение количества длинного аквапорина 4 может увеличить очистку от отходов, Сапкота проверил 2560 соединений на способность увеличивать считывание гена аквапорина 4. Он нашел два: апигенин, диетический флавон, содержащийся в ромашке, петрушке, луке и других съедобных растениях; и сульфахиноксалин, ветеринарный антибиотик, используемый в мясной и птицеводческой промышленности.
Сапкота и Догерти объединились с исследователями болезни Альцгеймера и соавторами Джоном Сиррито, доктором философии, адъюнкт-профессором неврологии, и Карлой Юэде, доктором философии, адъюнкт-профессором психиатрии, неврологии и неврологии, чтобы выяснить взаимосвязь между длинным аквапорином 4 и клиренсом бета-амилоида.
Исследователи изучали мышей, генетически модифицированных таким образом, чтобы иметь высокий уровень амилоида в мозгу. Они лечили мышей апигенином; сульфахиноксалин; инертная жидкость; или соединение плацебо, которое не влияет на чтение. Мыши, получавшие либо апигенин, либо сульфахиноксалин, избавлялись от бета-амилоида значительно быстрее, чем мыши, получавшие одно из двух неактивных веществ.
«Есть много данных, которые говорят о том, что снижение уровня амилоида всего на 20-25% останавливает накопление амилоида, по крайней мере, у мышей, и эффекты, которые мы наблюдали, были примерно такими», — сказал Киррито. «Это говорит мне о том, что это может быть новый подход к лечению болезни Альцгеймера и других нейродегенеративных заболеваний, связанных с агрегацией белков в головном мозге. Нет ничего, что говорило бы о том, что этот процесс специфичен для бета-амилоида. тоже, что может принести пользу людям с болезнью Паркинсона».
Сульфахиноксалин небезопасен для применения у людей. Апигенин доступен в виде пищевой добавки , но неизвестно, сколько его попадает в мозг , и Циррито предостерегает от употребления большого количества апигенина в попытке предотвратить болезнь Альцгеймера. Исследователи работают над поиском лучших препаратов, влияющих на выработку длинной формы аквапорина 4, тестируя несколько производных сульфахиноксалина и дополнительных соединений.
«Мы ищем что-то, что можно было бы быстро перенести в клинику», — сказал Сапкота. «Само по себе знание того, что на него вообще можно нацелить лекарство, является полезным намеком на то, что там будет что-то, что мы можем использовать».