Антибиотики обычно используются для лечения инфекций и обеспечения безопасности хирургических процедур. Однако их чрезмерное использование привело к появлению и распространению устойчивых бактерий, что привело к «гонке вооружений», в результате которой все более сильнодействующие лекарства становятся необходимостью. Поскольку устойчивость к противомикробным препаратам представляет собой постоянно растущую проблему здравоохранения во всем мире, исследователи из исследовательской группы системной экологии Люксембургского центра системной биомедицины (LCSB) и Департамента наук о жизни (DLSM), а также из группы молекулярных механизмов заболеваний в DLSM изучили влияние лечения антибиотиками микробного сообщества, обитающего в кишечнике мышей. Их результаты, недавно опубликованные в Nature Communications, подчеркните, что некоторые бактерии с большей вероятностью приобретают гены устойчивости к противомикробным препаратам, чем другие. Исследователи также описывают ключевые механизмы, участвующие в краткосрочной эволюции устойчивости к антибиотикам в кишечном микробиоме.
Изучение резистома кишечника на мышиной модели
Использование антибиотиков как для лечения болезней человека, так и в животноводстве способствовало нарастанию устойчивости к противомикробным препаратам (УПП) во всем мире. Многие бактерии в настоящее время выработали устойчивость к нескольким классам антибиотиков, что препятствует комплексному лечению инфекций и приводит к быстро растущему числу смертей во всем мире. Недавняя публикация в The Lancetпоказывает, что в 2019 г. глобальное бремя, связанное с лекарственно-устойчивыми инфекциями, оценивалось примерно в 5 миллионов смертей, из которых УПП была непосредственной причиной примерно 1,3 миллиона смертей. «Нынешняя тенденция явно не нисходящая, поскольку COVID-19 еще больше усугубляет проблему устойчивости к противомикробным препаратам, в результате чего к 2050 году у нас будет 10 миллионов смертей в год», — уточняет профессор Пол Уилмес, глава группы системной экологии. «Вот почему УПП в настоящее время называют «тихой пандемией». Тем не менее, еще многое предстоит узнать о его эволюции, временных масштабах и передаче».
Исследователи из Люксембургского университета использовали модель мыши, чтобы лучше понять механизмы, формирующие прогрессирование устойчивости к противомикробным препаратам. Путем лечения группы мышей коктейлем антибиотиков широкого спектра действия — репрезентативным для схем, используемых в предоперационных процедурах — и наблюдения за его влиянием на микробиом их кишечника с течением времени, они изучили, как некоторые бактерии приобретают гены устойчивости к противомикробным препаратам. «Мы разработали наше исследование, чтобы понять, на какой стадии приобретаются гены резистентности и как устойчивые патогены могут появиться после однократного курса антибиотиков», — объясняет доктор Лаура де Нис, научный сотрудник группы системной экологии и соавтор исследования. публикация.
Изменения в составе, вызванные антибиотиками
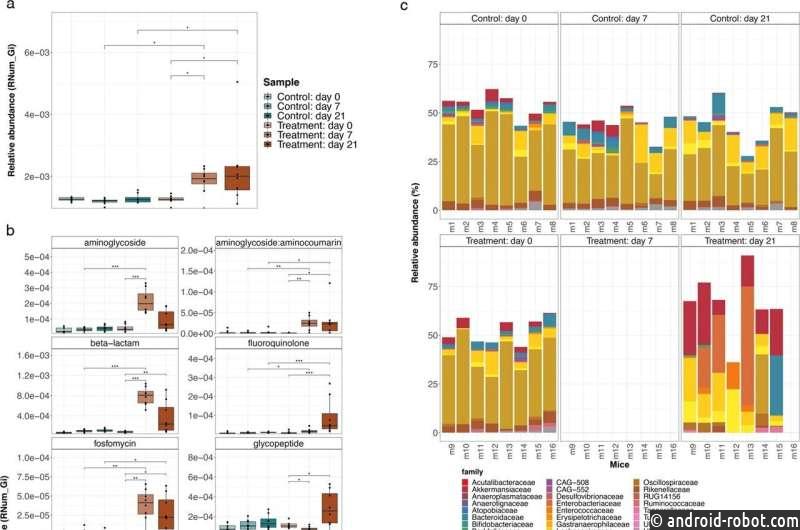
Исследователи наблюдали значительный сдвиг в составе кишечного микробиома у мышей, получавших антибиотики. В то время как большинство резидентных бактериальных популяций были истощены из-за лечения, Akkermansia muciniphila и представители семейств Enterobacteriaceae, Enterococcaceae и Lactobacillaceae оставались невосприимчивыми к лечению антибиотиками.
«Интересно, что мы уже знаем, что эти бактерии богаты в кишечнике пациентов с болезнью Паркинсона и связаны с другими хроническими заболеваниями», — добавляет доктор Элизабет Летелье, глава группы молекулярных механизмов заболеваний. «Тот факт, что они более устойчивы к антибиотикам, показывает, насколько широко могут быть последствия УПП и насколько важно лучше понять лежащие в их основе механизмы».
Увеличение генов устойчивости к противомикробным препаратам
Помимо изменений в составе кишечного микробиома, ученые также заметили, что у мышей, получавших антибиотики, наблюдалось значительно более высокое содержание генов устойчивости к противомикробным препаратам. В частности, они наблюдали увеличение генов, придающих устойчивость к трем из четырех введенных антибиотиков, и анализы показывают, что эти гены, вероятно, были приобретены с течением времени, а не изначально закодированы в ДНК бактерий. «Наши результаты показывают, что избирательное давление вводимых антибиотиков может привести к развитию устойчивости к противомикробным препаратам в микробиоме кишечника в реальном времени», — объясняет доктор Сушил Бхану Буси, член группы системной экологии и соавтор публикации. »
Устойчивость к противомикробным препаратам распространяется через мобильные генетические элементы
Уже известно, что бактерии могут развивать устойчивость к противомикробным препаратам посредством двух различных генетических механизмов: либо спонтанных мутаций, либо накопления и распространения генов устойчивости через мобильные генетические элементы (МГЭ). Эти элементы представляют собой тип генетического материала, который может передаваться от одного вида к другому. Они способствуют переносу генов резистентности между бактериальными популяциями посредством процесса, известного как горизонтальный перенос генов.
Чтобы лучше понять механизм, приводящий к наблюдаемому увеличению генов устойчивости к противомикробным препаратам у мышей, получавших антибиотики, исследователи исследовали роль МГЭ. Они обнаружили, что интегроны, особый тип мобильного генетического элемента, играют ключевую роль в обеспечении устойчивости к антибиотикам против вводимого коктейля антибиотиков. « Гены устойчивости , обнаруженные у мышей, которых лечили антибиотиками, в основном передавались интегронами, что подчеркивает недооцененный генетический механизм передачи устойчивости к антибиотикам», — описывает профессор Пол Уилмс. «Эти результаты проливают свет на краткосрочные процессы, формирующие состав сообществ, подвергающихся воздействию антибиотиков, и эволюцию устойчивости к противомикробным препаратам».
Поскольку многие из этих интегронов были связаны с геномами бактериальных семейств, устойчивых к лечению антибиотиками, таких как Akkermansiaceae и Enterobacteriaceae, эти находки также усиливают важность определенных таксономических групп. «Исследование подчеркивает ключевую роль конкретных бактерий, и, учитывая связь этих бактерий с некоторыми хроническими заболеваниями , нам необходимо продолжать изучать роль интегронов в содействии устойчивости к противомикробным препаратам внутри и за пределами этого таксона», — заключает профессор Уилмс.