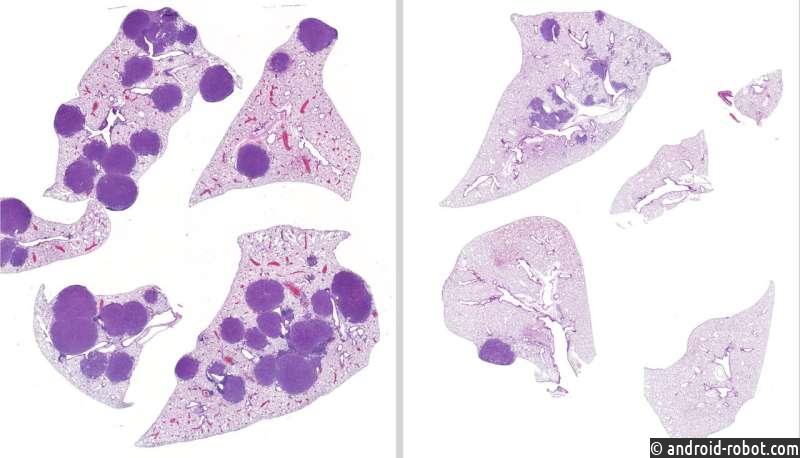
Новая комбинация лекарств работает вместе, чтобы уменьшить опухоли легких у мышей.
Лечение онкологии уже давно движется к персонализации — поиску правильных лекарств, которые работают для уникальной опухоли пациента, на основе определенных генетических и молекулярных моделей. Многие из этих целевых методов лечения высокоэффективны, но доступны не для всех видов рака, включая немелкоклеточный рак легкого (НМРЛ), который имеет генетическую мутацию LKB1.
Новое исследование, проведенное профессором Института Солка Рубеном Шоу и бывшим научным сотрудником Лилиан Эйхнер, а ныне доцентом Северо-Западного университета, показало, что одобренные FDA траметиниб и энтиностат (который в настоящее время проходит клинические испытания) можно давать в тандеме, чтобы производить меньше и меньше опухоли у мышей с НМРЛ с мутацией LKB1.
Результаты были опубликованы в журнале Science Advances 17 марта 2023 года.
«Для случаев немелкоклеточного рака легкого с мутацией LKB1 стандартные химиотерапевтические и иммунотерапевтические методы лечения неэффективны», — говорит Шоу, старший автор исследования и соавтор исследования, а также директор Онкологического центра Солка. «Наши результаты показывают, что есть способ нацелиться на эти случаи с помощью лекарств, одобренных FDA или уже прошедших клинические испытания, поэтому эту работу можно легко использовать для клинических испытаний на людях».
Примерно 20 процентов всех НМРЛ имеют генетическую мутацию LKB1, а это означает, что в настоящее время на рынке нет эффективных таргетных препаратов для пациентов с этим типом рака. Чтобы создать терапию, которая могла бы воздействовать на мутацию LKB1, исследователи обратились к деацетилазам гистонов (HDAC). HDAC представляют собой белки, связанные с ростом опухоли и метастазированием рака, с характерной сверхэкспрессией в солидных опухолях .
Несколько препаратов-ингибиторов HDAC уже одобрены FDA (безопасны для использования человеком) для определенных форм лимфомы, но данных об их эффективности при солидных опухолях или о том, могут ли опухоли, несущие определенные генетические изменения, проявлять повышенный терапевтический потенциал, не хватает.
Основываясь на предыдущих выводах, связывающих ген LKB1 с тремя другими HDAC, которые все зависят от HDAC3, команда начала с проведения генетического анализа HDAC3 в мышиных моделях НМРЛ, обнаружив неожиданно важную роль HDAC3 в нескольких моделях. Установив, что HDAC3 имеет решающее значение для роста трудноизлечимых LKB1-мутантных опухолей, исследователи затем изучили, может ли фармакологическая блокировка HDAC3 дать столь же мощный эффект.
Команде было любопытно протестировать два препарата: энтиностат (ингибитор HDAC в клинических испытаниях, который, как известно, нацелен на HDAC1 и HDAC3) и одобренный FDA траметиниб (ингибитор другого класса ферментов, связанных с раком). Опухоли часто быстро становятся устойчивыми к траметинибу, но совместное лечение препаратом, который ингибирует белок ниже HDAC3, помогает снизить эту устойчивость.
Поскольку этот белок зависит от HDAC3, исследователи полагали, что препарат, нацеленный на HDAC3, такой как энтиностат, также поможет справиться с устойчивостью к траметинибу.
После лечения мышей с мутантным LKB1 раком легких с различными схемами лечения в течение 42 дней команда обнаружила, что у мышей, получавших как энтиностат, так и траметиниб, объем опухоли был на 79% меньше, а в легких — на 63% меньше, чем у мышей, не получавших лечения. Кроме того, команда подтвердила, что энтиностат является жизнеспособным вариантом лечения в случаях, когда опухоль устойчива к траметинибу.
«Мы думали, что весь класс ферментов HDAC напрямую связан с причиной мутантного рака легких LKB1. Но мы не знали конкретной роли HDAC3 в росте опухоли легких», — говорит первый автор и соавтор Эйхнер. «Теперь мы показали, что HDAC3 необходим при раке легких, и что это лекарственная уязвимость при терапевтической резистентности».
Полученные результаты могут привести к клиническим испытаниям нового режима на людях, поскольку энтиностат уже проходит клинические испытания , а траметиниб одобрен FDA. Важно отметить, что Шоу рассматривает это открытие как преобразующее для рака за пределами НМРЛ, с потенциальным применением в лимфоме, меланоме и раке поджелудочной железы .
«Наша лаборатория посвятила этому проекту годы, предпринимая небольшие и значимые шаги к этим открытиям», — говорит Шоу, владелец кафедры Уильяма Р. Броди. «Это действительно история успеха того, как фундаментальные научные открытия могут привести к терапевтическим решениям в не столь отдаленном будущем».
«Моей независимой лаборатории посчастливилось быть частью Онкологического центра Лурье в Медицинской школе Файнберга Северо-Западного университета, который очень поддерживает трансляционные исследования. Мы надеемся, что эта среда будет способствовать началу клинических испытаний на основе этих результатов, «, — говорит Эйхнер.