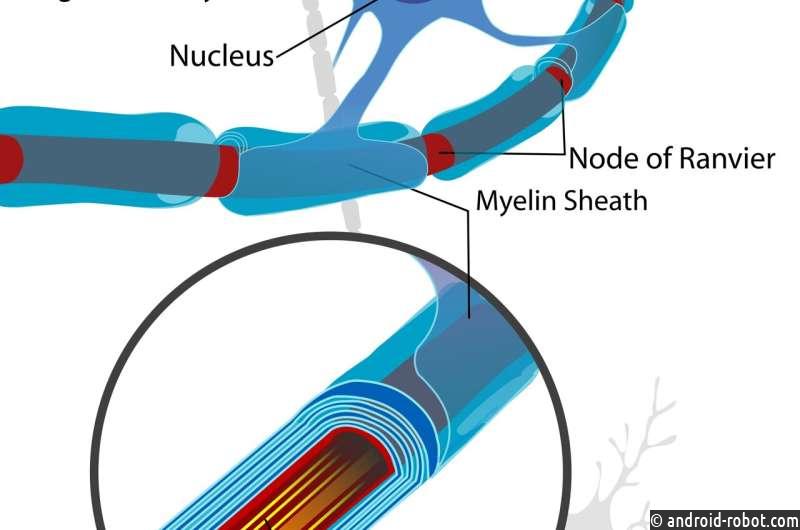
Жизнеспособное молекулярное объяснение происхождения компактного миелина позвоночных появилось давно. В то время как многие беспозвоночные, безусловно, способны обернуть свои аксоны грубыми глиальными отростками, никто не может справиться с чем-либо подобным массивным спиральным образованиям кристаллической протеолипидной мембраны, обнаруженным в олигодендроцитах центральной нервной системы и шванновских клетках периферической.
Функциональные ретротранспозоны постепенно вовлекаются во всевозможные нейробиологические явления. Поддержание идентичности и мозаицизма стволовых клеток, заболеваемость неврологическими заболеваниями и слияние клеток в головном мозге с помощью различных шиповидных белков теперь понимаются как работа для мобильных элементов. Написав на сервере препринтов bioRxiv , исследователи обнаружили, что миелин позвоночных, вероятно, возник, когда ретровирусные элементы были вставлены в геном в ключевые положения, чтобы вызвать массовую экспрессию их характерного белка, Mbp (основной белок миелина).
Mbp, по-видимому, появился одновременно с появлением челюстей и миелина и обнаружен у большинства древних ныне живущих позвоночных, восходящих к Chondrichthyes (хрящевым рыбам); однако не в Agnatha (бесчелюстная рыба). Кажется правдоподобным, что олигодендроциты развились путем кооптации существующих механизмов нейронов или астроцитов для создания нейритоподобных ветвящихся структур и объединения их со специализированными механизмами синтеза белков и липидов из шванновских клеток для построения миелина вместо синапсов на их концевых концах. В этом сценарии шванновские клетки обязательно эволюционировали бы первыми, чтобы ускорить или иным образом усилить сенсомоторные нервы, участвующие в быстром восприятии, щелчке или побеге. До сих пор исследователи изучали только олигодендроциты.
Ключевым элементом, который они обнаружили с помощью ретротранспозон-специфического чипа Affymetrix для крыс, является интеграза вирусного происхождения, известная как RNLTR12-int. Его консенсусная последовательность аннотирована как внутренняя последовательность эндогенного семейства ретровирусов ERV1, относительно распространенной группы, которая в настоящее время составляет около 3 процентов всего генома. RNLTR12-int — это всего лишь остаток классических ORF Gag-Pol (открытые рамки считывания), которые необходимы для цикла репликации провируса; В ней отсутствуют обычные длинные концевые повторы (LTR), которые часто замыкают эти конкретные элементы, и, вероятно, теперь она служит длинной некодирующей РНК.
Чтобы доказать это, исследователи сначала искали и обнаружили повышенную экспрессию RNLTR12-int-подобных последовательностей, теперь причудливо названных «ретромиелином», в олигодендроцитах широкой группы позвоночных. Затем они продемонстрировали, что эта ретровирусная эндогенизация является предполагаемым ключевым этапом в появлении позвоночных, продемонстрировав повышенную регуляцию Mbp посредством прямого связывания кодируемой им РНК с SOX10, сигнатурным фактором транскрипции для миелинизации. Любопытной особенностью иммиграции мобильных элементов в геном является их стиль пролиферации «якорный ребенок»: эти элементы содержат внутри себя вставочные последовательности, и поэтому, как только им удается превратиться в настоящую вставочную последовательность в каком-либо месте генома, дополнительные иностранные элементы, связанные с ними, автоматически получат возможность легкого проживания среди них. Вот какМобильные элементы всех типов сейчас составляют более половины нашего генома, несмотря на многочисленные попытки подавить их на молекулярном уровне.
Однако большинство первоначальных событий вставки останутся незамеченными, как только ретровирус, несущий RNLTR12-int-подобную последовательность, случайным образом интегрируется в зародышевую линию либо во время первичного инфицирования; в качестве альтернативы, он может передаваться по наследству путем соматического доступа к зародышу позже путем переноса из других клеток через кровь или нерв. Скрытно размножаясь с помощью обратной транскрипции и реинтеграции, эти последовательности, в конце концов, наткнулись на регуляторные области для зарождающегося захвата Mbp, после чего они были зафиксированы для потомства после того, как доказали свою эффективность. Все другие миелиновые белки, такие как MAL, MAG, CNP, PLP, PMP22, TSPAN2, намного старше эволюционно и хорошо зарекомендовали себя у немиелинизированных бесчелюстных позвоночных и беспозвоночных. Как правило, после интеграции наблюдается неумолимая дегенерация вирусной функциональности.
Чтобы дать некоторый дополнительный контекст того, что все это может означать, может быть полезно ввести большую роль миелина в экосистеме аксонов позвоночных в более широкую сферу мысли, где могут быть изучены дополнительные детали. Недавно мы обсуждали образование АТФ в миелине в контексте потенциального внемитохондриального окислительного фосфорилирования. Но это не единственный способ для аксонов получить необходимую им энергию. На самом деле, недавно было обнаружено, что нейроны могут запрашивать и получать дополнительные митохондрии от соседних клеток, чтобы компенсировать нехватку энергии или дефицит кислорода после травмы. Точный метод, предпочитаемый далеко идущими и уникальными биполярными сенсорными нейронами ганглия дорсального корешка, заключается в подавлении макрофагов M2, экспрессирующих CD200.использование нейрональных рецепторов Isec1 для взаимодействия с их собственными комплементарными рецепторами CD206, что в конечном итоге приводит к отправке пузырьков, заполненных митохондриями.
Альтернативный метод, используемый клетками миеломы для приобретения митохондрий из стволовых клеток костного мозга, заключается в отправке ретроградного сигнала, состоящего из молекул CD38 .направить строительство магистрали из нанотрубок, построенной из различных белков цитоскелета для транспортировки митохондрий. «CD» в этих белках обозначает кластер дифференцировки, и традиционно они были обнаружены в качестве маркеров поверхности иммунных клеток. Эти белки часто являются гликопротеинами и могут содержать различные воплощения и повторы исходных доменов иммуноглобулина, широко используемых в антителах. В ходе эволюции многие из них были приспособлены к лунному свету в качестве молекул адгезии в нервной системе, чтобы управлять выбором партнеров в синапсах, специфичностью фасцикуляций аксонов или определять толщину и расстояние между слоями спиральных глиальных оболочек миелина.
Маркер CD206 представляет собой лектин типа С, который может действовать как маннозный рецептор на макрофагах. Этот рецептор непрерывно рециркулирует между плазматической мембраной и эндосомальными компартментами клатрин-зависимым образом. Можно сделать вывод или, по крайней мере, обоснованно предположить, что это действие может создавать мембранные нарушения достаточной величины, чтобы оппортунистические везикулы, нагруженные митохондриями, могли найти место для приземления и колонизации. Подобные виды поведения задают несколько интригующих вопросов. Например, имеют ли нейроны, даже здоровые и нормально активные нейроны, врожденные ограничения в их способности создавать митохондрии? Ограничения возможности доступа к требуемым кодируемым ядром митохондриальным белкам неизменно возникают из-за врожденных ограничений на экспрессию генов, диктуемых эклектическими потребностями белков в дифференцировке нервных клеток,хемотаксическое поведение митохондрий яйцеклетки в ответ на слияние сперматозоидов у мышей.
Между прочим, многие случаи клеточной дифференцировки теперь можно рассматривать как еще один изначально бездыханный, но позже случайный побочный продукт вставки мобильного элемента в промоторные области для активации генов, которые индуцируют в клетках более благоприятную среду для пролиферации элемента. Разнообразные глубокие молекулярные связи между нейронами, глиальными и иммунными клетками могут также свидетельствовать о том, что аксоны могли первоначально заманивать клетки крови или соответствующим образом оборудованные клетки микроглии, чтобы иммунологически защищать их с помощью молекул клеточной адгезии, связанных с иммуноглобулином.и цитоплазматические молекулы защиты от вирусов, в частности, те из семейств Toll и родственных молекул, которые могут ощущать и распознавать сегменты нуклеиновых кислот определенной длины или содержания. Затем, в течение долгого времени эволюции, эти защитные клетки были преобразованы в специальные миелиновые обертывающие агенты, генетически импринтированные для постоянного питания аксонов.