Ученые из Scripps Research совместно с коллегами из Японии обнаружили, как «отравленная» форма белка может запускать каскад событий, стимулирующих рост некоторых видов рака. Исследование, опубликованное в Nature Communications 4 февраля, также послужило толчком к разработке препарата-кандидата, который может возвращать белок в его нормальную форму. У мышей с раком толстой кишки препарат предотвращал или резко замедлял образование опухолей.
«Это потенциально очень важная и лекарственная связь между окружающей средой, генами и раком», — говорит старший автор Стюарт Липтон, доктор медицинских наук, профессор и заведующий кафедрой молекулярной медицины Scripps Research and Health Foundation. клинический невролог в Ла-Хойя, Калифорния.
Исследование проводилось в сотрудничестве с командой под руководством Такаши Уэхары из Университета Окаяма в Японии.
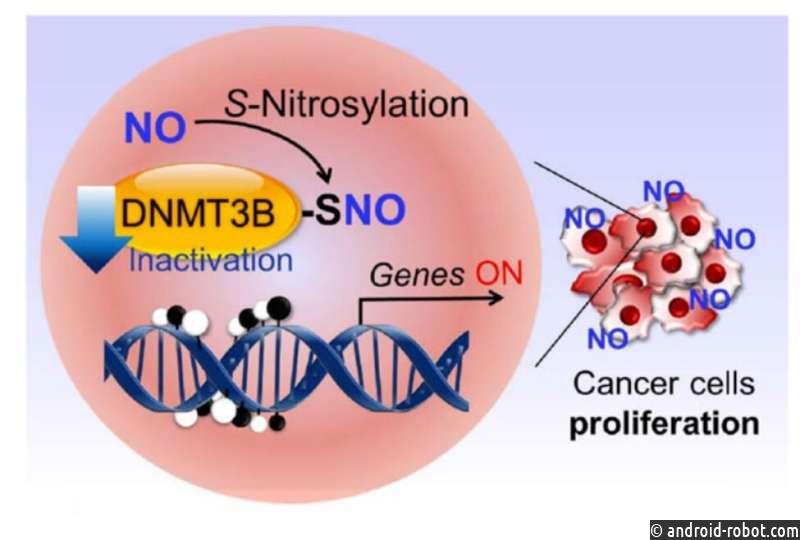
Исследовательская группа Липтона ранее обнаружила процесс, называемый S-нитрозилированием белка, в котором молекула, связанная с оксидом азота (NO), связывается с атомами серы внутри белков, чтобы изменить функции этих белков. NO естественным образом содержится в организме и вырабатывается в ответ на воспаление. Но он также может образовываться из нитратов и нитритов, которые употребляются в пищу (в виде переработанного мяса) или вдыхаются (через сигаретный дым или загрязненный воздух). Недавно команда показала, как S-нитрозилирование может способствовать развитию болезни Альцгеймера, а также болезни Паркинсона, деменции с тельцами Леви, болезни Лу Герига (БАС) и некоторых формах аутизма.
Кроме того, ученые знают, что многие гены могут быть включены или выключены белками, называемыми ДНК-метилтрансферазами (процесс, известный как эпигенетический контроль экспрессии генов). Когда эти белки добавляют метильную группу — своего рода химический маркер — к цепи ДНК, они не дают активироваться соседним генам. При некоторых видах рака эти метиловые «глушители» удаляются, и гены, участвующие в росте и распространении опухоли, ненормально включаются.
«Если вы блокируете метилирование, гены включаются, когда не должны, и это, как известно, является важным фактором некоторых видов рака», — говорит Липтон. «Но никто не знал главного триггера этого процесса».
В своей работе Липтон вместе с исследователем Scripps Research Томохиро Накамурой и их коллегами из Японии показали, что когда ДНК-метилтрасфераза 3B (DNMT3B) подвергается S-нитрозилированию, что может происходить в присутствии высоких уровней NO, она больше не добавляет метильные группы. к ДНК. Затем это позволяет включить определенные гены, вызывающие рак. Полученные данные предполагают, что переработанное мясо, загрязнение воздуха, сигаретный дым и воспаление — все это связано с некоторыми формами рака — может превратить DNMT3B в его форму, способствующую развитию рака.
«Это похоже на отравленную форму DNMT3B», — говорит Липтон.
Далее группа показала, что когда DNMT3B «отравляют» таким образом, уровни экспрессии 173 различных генов в клетках человека изменяются. Среди этих генов есть Ccnd2, который, как уже было известно, участвует в формировании рака желудка и толстой кишки у людей.
Затем исследовательская группа в Японии разработала лекарство, которое предотвратит S-нитрозилирование DNMT3B, но не заблокирует его нормальную функцию и не повлияет на S-нитрозилирование любых других белков. Это предотвратило превращение NO, даже при его высоком уровне, в «отравленную» форму DNMT3B.
Команды Липтона и Уэхары обнаружили, что препарат, известный как DBIC, предотвращает превращение изолированных предраковых клеток толстой кишки в полномасштабный рак толстой кишки в лаборатории. Более того, когда они давали DBIC мышам, склонным к раку толстой кишки, препарат практически предотвращал образование опухолей, даже когда воспаление вызывало высокие уровни NO.
Исследователи считают, что S-нитрозилирование DNMT3B, вероятно, связано с другими видами рака, включая рак головного мозга и рак молочной железы . Они планируют провести дополнительные исследования полного списка генов, на которые влияет S-нитрозилированный DNMT3B.
«Мы до сих пор не знаем полного набора типов опухолей, с которыми может быть связан этот молекулярный переключатель», — говорит Липтон. «Мы будем заниматься этим в будущем, а также пытаться перевести DBIC на клинические испытания на людях».