Мощный микроскоп фиксирует первое изображение из наноразмерного пространства, которое способствует движению клеток.
Есть много раз, когда наши клетки должны двигаться. Мобильные клетки определяют формирование нашего организма (эмбриональное развитие). Иммунные клетки бродят, чтобы захватить нежелательных вторжений. И заживающие клетки (фибробласты) мигрируют, чтобы залечить раны. Но не все движения желательны: опухоли наиболее опасны, когда раковые клетки приобретают способность перемещаться по всему телу (метастазирование).
Некоторые бактерии и вирусы могут использовать механизм подвижности клеток для проникновения в наши тела. Понимание того, как движутся клетки, и нитевидные актиновые филаменты, которые управляют процессом, является ключом к изучению того, как остановить или повысить подвижность для улучшения здоровья человека.
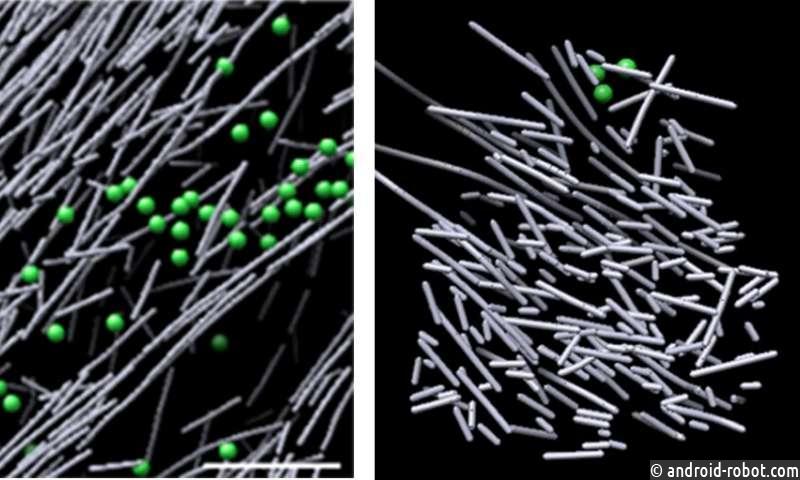
Теперь, используя один из самых мощных микроскопов в мире, ученые из Медицинского института открытий им. Сэнфорда Бернхэма Пребиса (SBP) и Университета Северной Каролины в Чапел-Хилле (UNC-Чапел-Хилл) определили плотную, динамическую и неорганизованную наноаффолд из актиновых филаментов — напоминает стог сена — это вызвано в ответ на молекулярный сигнал . Это первый раз, когда исследователи непосредственно визуализируют на молекулярном уровне структуру, которая срабатывает в ответ на клеточный сигнал — ключевой вывод, который расширяет наше понимание того, как двигаются клетки . Это исследование было опубликовано в трудах Национальной академии наук Соединенных Штатов Америки ( PNAS ).
«Тироэлектронная микроскопия революционизирует наше понимание внутренней работы клеток», — говорит Дорит Хейнн, доктор философии, старший автор статьи и профессор программы биоинформатики и структурной биологии в SBP. «Эта технология позволила нам собирать надежные, трехмерные изображения областей клеток — подобно МРТ, которое создает детальные изображения нашего тела. Мы смогли визуализировать клетки в их естественном состоянии, которое выявило ранее невиданный актин нано-архитектура внутри клетки «.
В исследовании ученые использовали крио-электронный микроскоп SBP (Titan Krios), искусственный интеллект (AI) и индивидуальные подходы к вычислительной и клеточной визуализации для сравнения наноразмерных изображений фибробластов мыши с легкими метками времени флуоресцентного Rac1, белка с метками времени. который регулирует движение клеток, реакцию на силу или напряжение (механосенсирование) и инвазию патогена. Этот технически сложный рабочий процесс, который преодолел пять порядков в масштабе (от десятков микрон до нанометров), занял годы, чтобы развиться до его нынешнего уровня надежности и точности, и стал возможным благодаря экспериментальным и вычислительным усилиям групп структурных биологов в SBP и группа биосенсоров в UNC-Chapel Hill.
Изображения показали плотно упакованную, неорганизованную, подобную скаффолду структуру, состоящую из коротких стержней актина. Эти структуры появились в определенных областях, где Rac1 был активирован, и быстро рассеялись, когда прекратилась передача сигналов Rac1 — всего за две с половиной минуты. Этот динамический каркас резко контрастировал с различными другими актиновыми сборками в областях с низкой активацией Rac1 — некоторые состояли из длинных, выровненных стержней актина, а другие — из коротких актиновых стержней, разветвляющихся со стороны более длинных актиновых филаментов. Объем, охватывающий актиновый каркас, был лишен общих клеточных структур, таких как рибосомы, микротрубочки, везикулы и многое другое, вероятно, из-за интенсивной плотности структуры.
«Мы были удивлены, что эксперимент за экспериментом выявил эти уникальные горячие точки не выровненных, плотно упакованных актиновых стержней в областях, которые коррелировали с активацией Rac1», — говорит доктор философии Нильс Фолькманн, соавтор статьи, возглавлявшей вычислительную часть. исследования и профессор в программе биоинформатики и структурной биологии в SBP. «Мы полагаем, что это нарушение на самом деле является сильной стороной эшафот — оно предоставляет гибкость и универсальность для создания более крупных, сложных актиновых нитевидных архитектур в ответ на дополнительные локальные пространственные сигналы».
Затем ученые хотели бы расширить протокол для визуализации большего количества структур, которые создаются в ответ на другие молекулярные сигналы, и для дальнейшей разработки технологии, обеспечивающей доступ к другим областям клетки.
«Это исследование — только начало. Теперь, когда мы разработали этот количественный рабочий процесс в наномасштабе, который коррелирует динамическое поведение сигналов с наноразмерным разрешением электронной криотомографии, мы и другие ученые можем реализовать этот мощный аналитический инструмент не только для расшифровки внутренних процессов. движения клеток, а также для выяснения динамики многих других макромолекулярных машин в невозмущенной клеточной среде », — говорит Хейнн.
Она добавляет: «Актин является строительным белком; он взаимодействует с более чем 150 актин-связывающими белками, создавая разнообразные структуры, каждая из которых выполняет уникальную функцию. У нас есть избыток различных сигналов, которые мы хотели бы отобразить, которые могли бы привести даже к больше понимания того, как двигаются клетки «.